Missions principales:
Les principales missions de Cochrane France sont les suivantes :
1. Promouvoir les prises de décisions fondées sur les données probantes en santé, notamment en participant à la rédaction de méta-analyses et de revues systématiques pour enrichir la bibliothèque Cochrane mondiale ;
2. Promouvoir l’accès et l’utilisation des revues systématiques Cochrane dans les prises de décisions en France et dans les pays francophones, notamment en diffusant les travaux de Cochrane ;
3. Former à la réalisation et à l’utilisation de synthèses des données probantes pertinentes, rigoureuses et fiables ;
4. Promouvoir une recherche méthodologique innovante sur la synthèse des données probantes et diffuser les concepts d’Evidence-Based Medicine.
Nos travaux de recherche
L’implication des membres de Cochrane France dans les diverses instances de la collaboration est en constante progression. Philippe Ravaud était président du comité scientifique ; Isabelle Boutron est membre du réseau des directeurs de centre, co-directrice du groupe Methods Bias; membre de l’advisory board pour développer la stratégie de la collaboration et membre du comité éditorial. Anna Chaimani est co-chair du Cochrane Statistical Methods Group et du Cochrane Comparing Multiple Interventions Methods Group. Nous coordonnons aussi le réseau francophone Cochrane, qui rassemble Cochrane Canada Francophone, Cochrane Suisse, Cochrane Belgique et Cochrane Cameroun. Ces implications permettent à Cochrane France de faire entendre sa voix et d’influer sur les grands axes stratégiques de l’organisation.
Ci-dessous nous présentons quelques-uns des projets sur lesquels nous travaillons actuellement.
L’initiative COVID-NMA :
Une synthèse des connaissances (données probantes) sur l’efficacité des traitements contre la COVID-19, mise à jour en temps réel, pour informer les décisions de santé publique.
En 2020, dès le début de la pandémie, Cochrane France s’est totalement mobilisé pour répondre à l’urgence sanitaire.
Notre analyse des besoins des décideurs en santé et des soignants a conclu que l’approche classique de synthèse des données probantes focalisée sur des questions de recherche précises à un moment donné avec une communication des résultats via des publications scientifiques n’est pas adaptée aux besoins des acteurs. Notre analyse a conclu à la nécessité de produire une synthèse des données probantes « vivante » c’est à dire mise à jour en temps réel pour tous les traitements et interventions préventives contre la COVID-19 et dont les résultats sont disponibles sur une plateforme ouverte. Par ailleurs, une cartographie des tous les essais planifiés, en cours ou terminés à jour est nécessaire pour aider les financeurs et les chercheurs à identifier les champs de recherche prioritaires. L’initiative COVID-NMA a été créée en février 2020 et une première plateforme disponible dès février 2020. En mars 2020 une mise à jour des résultats et analyses était faite de façon hebdomadaire.
Notre objectif était d’aider les prises de décisions fondées sur les preuves en produisant:
1) des revues systématiques et méta-analyses « vivantes » évaluant les traitements et vaccins contre la COVID-19
2) une cartographie « vivante », c’est à dire mise à jour en temps réel, de toutes les études cliniques enregistrées au niveau mondial.
Ce projet a été mené en collaboration avec plusieurs centres Cochrane (Cochrane Ireland, Cochrane Germany, Cochrane Denmark, Cochrane Chile, Cochrane South Africa).
Production scientifique
1. Pierre O, Riveros C, Charpy S, Boutron I. Secondary electronic sources demonstrated very good sensitivity for identifying studies evaluating interventions for COVID-19. Journal of clinical epidemiology. 2022
2. Kapp P, Esmail L, Ghosn L, Ravaud P, Boutron I. Transparency and reporting characteristics of COVID-19 randomized controlled trials. BMC Med. 2022
3. Graña C, Ghosn L, Evrenoglou T, Jarde A, Minozzi S, Bergman H, et al. Efficacy and safety of COVID19 vaccines. The Cochrane database of systematic reviews. 2022
4. Davidson M, Menon S, Chaimani A, Evrenoglou T, Ghosn L, Graña C, et al. Interleukin-1 blocking agents for treating COVID-19. The Cochrane database of systematic reviews. 2022
5. Evrenoglou T, White IR, Afach S, Mavridis D, Chaimani A. Network meta-analysis of rare events using penalized likelihood regression. Statistics in medicine. 2022
6. Hróbjartsson CHNAFA. Training manual for RoB 2 risk of bias assessment in COVID-19 trials eligible for the COVID-19 living network meta-analysis. Zenodo 2022
7. Ghosn L, Assi R, Evrenoglou T, Buckley BS, Henschke N, Probyn K, et al. Interleukin-6 blocking agents for treating COVID-19: a living systematic review. The Cochrane database of systematic reviews 2023
8. Evrenoglou T, Boutron I, Seitidis G, Ghosn L, Chaimani A. metaCOVID: A web-application for living meta-analyses of COVID-19 trials. Research synthesis methods. 2023
9. Esmail LC, Kapp P, Assi R, Wood J, Regan G, Ravaud P, et al. Sharing of Individual Patient-Level Data by Trialists of Randomized Clinical Trials of Pharmacological Treatments for COVID-19. Jama. 2023
10. Cheurfa C, Tsokani S, Kontouli KM, Boutron I, Chaimani A. Empirical evaluation of the methods used in systematic reviews including observational studies and randomized trials. Journal of clinical epidemiology. 2023
11. Davidson M, Evrenoglou T, Graña C, Chaimani A, Boutron I. No evidence of important difference in summary treatment effects between COVID-19 preprints and peer-reviewed publications: a metaepidemiological study. Journal of clinical epidemiology. 2023
12. Davidson M, Evrenoglou T, Graña C, Chaimani A, Boutron I. Comparison of effect estimates between preprints and peer-reviewed journal articles of COVID-19 trials. BMC medical research methodology. 2024
Méta-analyse en réseau
Méta-analyse en réseau
La méta-analyse en réseau est une méthode apparue depuis une dizaine d’années qui permet d’établir l’efficacité relative de différents traitements, qu’ils aient ou pas été comparés directement (deux à deux) dans des études individuelles. Cette méthode est de plus en plus utilisée pour déterminer quelles sont, parmi tous les traitements qui existent pour une maladie spécifique, les meilleures interventions disponibles. Nos travaux de recherche ont pour but de développer les outils et méthodes nécessaires à la bonne application de cette approche.
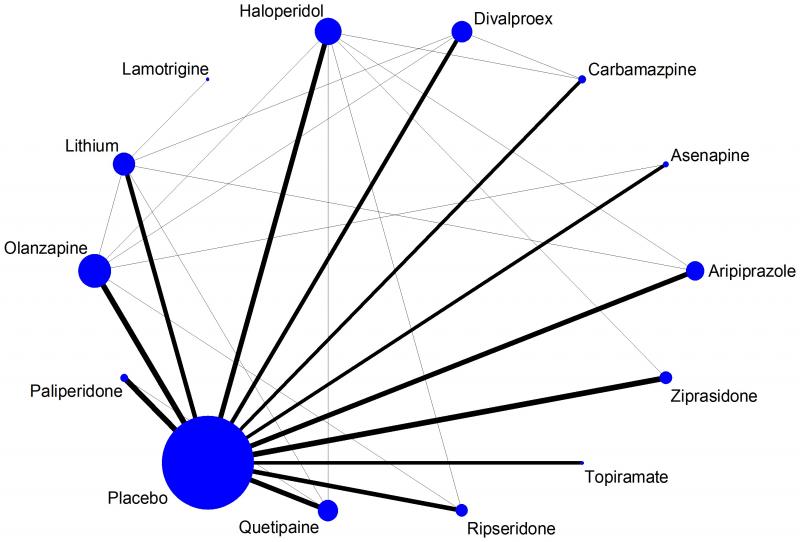
Figure 1: Network plot of the acute mania network (efficacy outcome). Anna Chaimani et al. PLoS ONE. 2013; 8(10): e76654
Exemple de diagramme en réseau, comparant les différents traitements pour les épisodes maniaques aigus. La taille des cercles reflète le nombre de fois où le traitement a été étudié dans la littérature; l'épaisseur des lignes est proportionnelle au nombre de fois où deux traitements ont été directement comparés dans la littérature.
Pour en savoir plus:
James A, Yavchitz A, Ravaud P, Boutron I. Node-making process in network meta-analysis of nonpharmacological treatment are poorly reported. Journal of Clinical Epidemiology. 2018. 97:95-102 https://www.ncbi.nlm.nih.gov/pubmed/29196202
Chaimani A, Caldwell DM, Li T, Higgins JPT, Salanti G. Additional considerations are required when preparing a protocol for a systematic review with multiple interventions. Journal of Clinical Epidemiology. 2017. 83:65-74 https://www.ncbi.nlm.nih.gov/pubmed/28088593
Trinquart L, Attiche N, Bafeta A, Porcher R, Ravaud P. Uncertainty in Treatment Rankings: Reanalysis of Network Meta-analyses of Randomized Trials. Annals of Internal Medicine. 2016. 164(10):666-73 https://www.ncbi.nlm.nih.gov/pubmed/27089537
Bafeta A, Trinquart L, Seror R, Ravaud P. Reporting of results from network meta-analyses: methodological systematic review. BMJ. 2014. 348:g1741 https://www.ncbi.nlm.nih.gov/pubmed/24618053
Chaimani A, Higgins JPT, Mavridis D, Spyridonos P, Salanti G. Graphical tools for network meta-analysis in STATA. PLoS ONE. 2013, 8(10): e76654 https://www.ncbi.nlm.nih.gov/pubmed/24098547
Méta-analyse en réseau cumulative et dynamique
Les revues systématiques conventionnelles ne couvrent jamais la totalité des preuves disponibles et leurs données sont rarement à jour. Pour remédier à ces limites, nos chercheurs développent une nouvelle forme de synthèse des données : la méta-analyse en réseau cumulative et dynamique. Le diagramme ci-après résume les différentes étapes de cette méthode innovante :
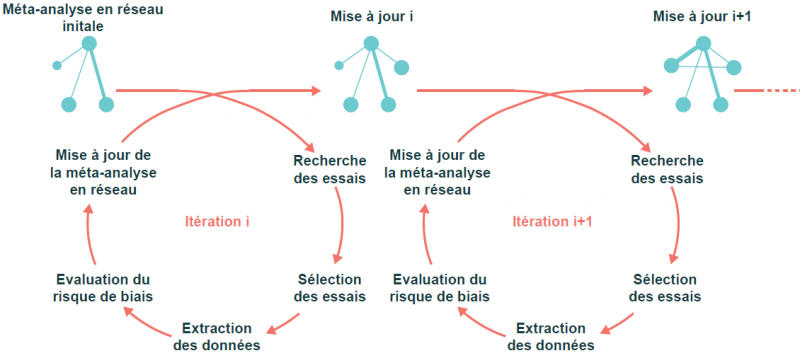
Figure 2: Etapes de la méta-analyse en réseau cumulative et dynamique
Pour en savoir plus sur cette nouvelle forme de synthèse des données, vous pouvez consulter le site internet dédié https://livenetworkmetaanalysis.com/.
Vous y trouverez une application pour les traitements de deuxième ligne des cancers bronchiques non à petites cellules.
Pour en savoir plus :
Créquit P, Martin-Montoya T, Attiche N, Trinquart L, Vivot A, Ravaud P. Living network meta-analysis was feasible when considering the pace of evidence generation. J Clin Epidemiol 2019;108:10–6. doi:10.1016/j.jclinepi.2018.12.008. https://www.sciencedirect.com/science/article/pii/S089543561830708X?via%3Dihub
Lerner I, Créquit P, Ravaud P, Atal I. Automatic screening using word embeddings achieved high sensitivity and workload reduction for updating living network meta-analyses. J Clin Epidemiol 2019;108:86–94. doi:10.1016/j.jclinepi.2018.12.001. https://www.sciencedirect.com/science/article/pii/S0895435618305985?via%3Dihub
Créquit P, Mansouri G, Benchoufi M, Vivot A, Ravaud P. Mapping of Crowdsourcing in Health: Systematic Review. J Med Internet Res 2018;20:e187. doi:10.2196/jmir.9330. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5974463/
Créquit P, Chaimani A, Yachvitz A, Attiche N, Cadranel J, Trinquart L, Ravaud P. Comparative efficacy and safety of second-line treatments for advanced non-small cell lung cancer with wild-type or unknown status for epidermal growth factor receptor: a systematic review and network meta-analysis. BMC Medicine. 2017. 15(1):193 https://www.ncbi.nlm.nih.gov/pubmed/29082855
Créquit P, Trinquart L, Ravaud P. Live cumulative network meta-analysis: protocol for second-line treatments in advanced non-small-cell lung cancer with wild-type or unknown status for epidermal growth factor receptor. BMJ Open. 2016, 6(8):e011841 https://www.ncbi.nlm.nih.gov/pubmed/27489157
Créquit P, Trinquart L, Yachvitz A, Ravaud P. Wasted research when systematic reviews fail to provide a complete and up-to-date evidence synthesis: the example of lung cancer. BMC Medicine. 2016. 14:8 https://www.ncbi.nlm.nih.gov/pubmed/26792360
Nouvelles sources de données
Les biais dans la façon dont les résultats de recherche sont présentés dans les articles scientifiques sont un problème majeur pour la validité et la crédibilité des revues systématiques. Nous explorons comment les nouvelles sources de données (registres d’essais cliniques, plateformes de partages de données de recherche) peuvent être utilisées pour corriger ces biais.
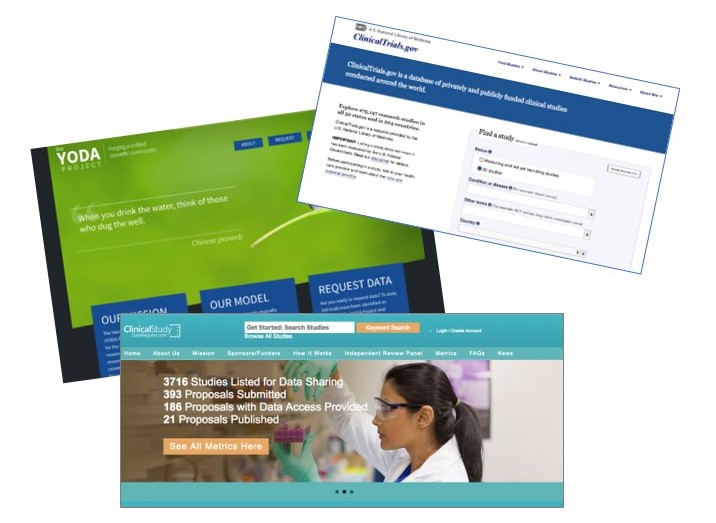
Figure 3: Exemples de nouvelles sources de données
Pour en savoir plus :
Baudard M, Yavchitz A, Ravaud P, Perrodeau E, Boutron I. Impact of searching clinical trial registries in systematic reviews of pharmaceutical treatments: methodological systematic review and reanalysis of meta-analyses. BMJ. 2017. 356:j448 https://www.ncbi.nlm.nih.gov/pubmed/28213479
Boutron I, Dechartres A, Baron G, Li J, Ravaud P. Sharing of Data From Industry-Funded Registered Clinical Trials. JAMA. 2016. 315(24):2729-30 https://www.ncbi.nlm.nih.gov/pubmed/27367768
Riveros C, Dechartres A, Perrodeau E, Haneef R, Boutron I, Ravaud P. Timing and completeness of trial results posted at ClinicalTrials.gov and published in journals. PLoS Medicine. 2013. 10(12):e1001566 https://www.ncbi.nlm.nih.gov/pubmed/24311990
Biais induit par la sélection des résultats rapportés (selective outcome reporting bias)
La déclaration sélective des résultats a des conséquences importantes ; lorsqu'elle favorise un résultat statistiquement significatif, elle peut entraîner une surestimation de l'effet du traitement et fausser les preuves médicales. Nous nous penchons actuellement sur les meilleurs moyens d’évaluer la prévalence de cette source de biais, et d’y palier.
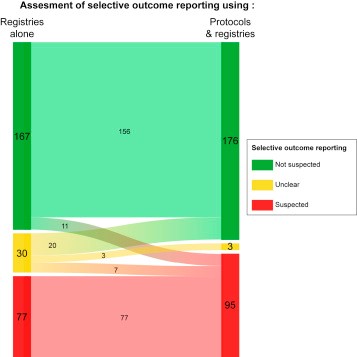
Figure 4: Contribution des protocoles à l'évaluation de la sélection des résultats rapportés. Louis Calméjane et al. Journal of Clinical Epidemiology 2018; 104:95-102
Pour en savoir plus :
Calméjane L, Dechartres A, Tran VT, Ravaud P. Making protocols available with the article improved evaluation of selective outcome reporting. Journal of Clinical Epidemiology. 2018. 104:95-102 https://www.ncbi.nlm.nih.gov/pubmed/30196127
Bonnot B, Yavchitz A, Mantz J, Paugam-Burtz C, Boutron I. Selective primary outcome reporting in high-impact journals of anaesthesia and pain. British Journal of Anaesthesia. 2016. 117(4):542–543 https://www.ncbi.nlm.nih.gov/pubmed/28077557
Étude des facteurs qui influent sur les estimations des effets du traitement à l'aide de la méta-épidémiologie
Les méta-analyses sont utilisées pour distiller l'information de multiples études en une estimation unique. Nos recherches, basées sur des études méta-épidémiologiques, montrent que plusieurs facteurs (exemples : essais dans un seul centre, taille de l'échantillon, choix de la mesure de l'effet du traitement) sont associés aux effets surestimés des traitements. Cette constatation remet en question la stratégie actuellement privilégiée par les auteurs de revues, qui consiste à inclure toutes les données probantes disponibles ; nous étudions les possibilités offertes par d’autres stratégies, comme la méta-analyse incluant les essais les plus précis seulement, la méta-analyse des essais les plus importants ou encore la méta-analyse ajustée en fonction du biais (limit meta-analysis).
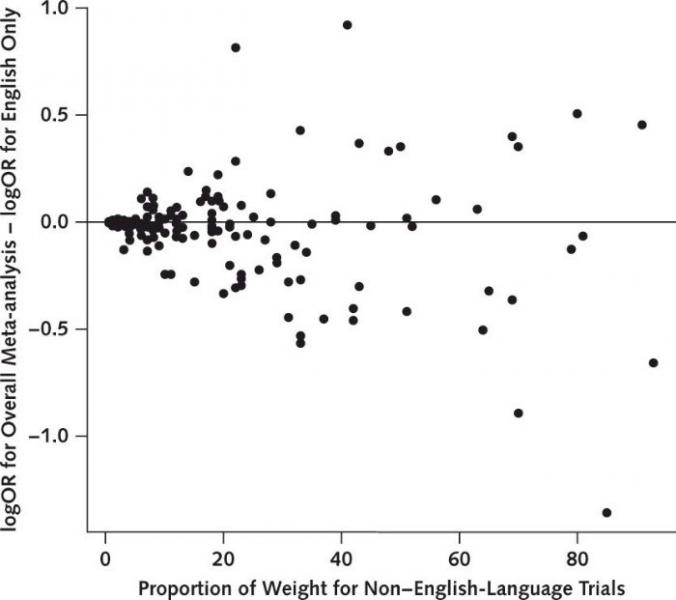
Figure 5: Effet du poids cumulatif des publications non anglophones sur la différence entre les méta-analyses de tous les essais publiés et la méta-analyses limitées aux publications anglophone. Agnes Dechartres et al. Annals of Internal Medicine 2018 ;169(6) :385-393
Pour en savoir plus :
Dechartres A, Atal I, Riveros C, Meerpohl J, Ravaud P. Association Between Publication Characteristics and Treatment Effect Estimates: A meta-epidemiologic Study. Annals of Internal Medicine. 2018. 169(6):385-393 https://www.ncbi.nlm.nih.gov/pubmed/30140933
Dechartres A, Altman DG, Trinquart L, Boutron I, Ravaud P. Association between analytic strategy and estimates of treatment outcomes in meta-analyses. JAMA. 2014. 312(6):623-30 https://www.ncbi.nlm.nih.gov/pubmed/25117131
Dechartres A, Trinquart L, Boutron I, Ravaud P. Influence of trial sample size on treatment effect estimates: meta-epidemiological study. BMJ. 2013. 346:f2304 https://www.ncbi.nlm.nih.gov/pubmed/23616031
Présentation des résultats de recherche dans les articles scientifiques (Reporting)
Le contenu des articles rapportant les résultats d’essais cliniques est déterminant pour comprendre leur validité et pour pouvoir les reproduire. Or très souvent, les détails fournis ne sont pas suffisants. Nos travaux mettent en lumière le manque d’informations dans des domaines spécifiques tels que l’intervention elle-même, les méthodes employées pour l’évaluer et les effets indésirables.
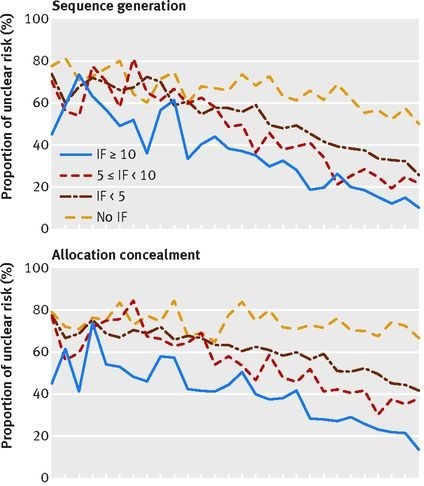
Figure 6: Evolution de la présentation des résultats de recherche dans 20920 articles portant sur des essais cliniques, suivant le score d’impact (impact factor) de la revue. Agnès Dechartres et al. BMJ 2017;357:bmj.j2490
Pour en savoir plus :
Bafeta A, Koh M, Riveros C, Ravaud P. Harms Reporting in Randomized Controlled Trials of Interventions Aimed at Modifying Microbiota: A Systematic Review. Annals of Internal Medicine. 2018. 169(4):240-247 https://www.ncbi.nlm.nih.gov/pubmed/30014150
Bafeta A, Yavchitz A, Riveros C, Batista R, Ravaud P. Methods and Reporting Studies Assessing Fecal Microbiota Transplantation: A Systematic Review. Annals of Internal Medicine. 2017. 167(1):34-39 https://www.ncbi.nlm.nih.gov/pubmed/28531908
Dechartres A, Trinquart L, Atal I, Moher D, Dickersin K, Boutron I, Perrodeau E, Altman DG, Ravaud P. Evolution of poor reporting and inadequate methods over time in 20 920 randomised controlled trials included in Cochrane reviews: research on research study. BMJ. 2017. 357:j2490 https://www.ncbi.nlm.nih.gov/pubmed/28596181
Présentation déformée des résultats de recherche (spin)
Notre équipe a développé le concept de "spin" en recherche clinique. Le spin est une manière spécifique de rapporter les résultats de recherche qui ne reflète pas fidèlement leur nature et leur diversité. Nous étudions l’impact de ce spin sur l’interprétation des lecteurs et, travaillons à la réduction du recours au spin dans les rapports de résultats de recherche.
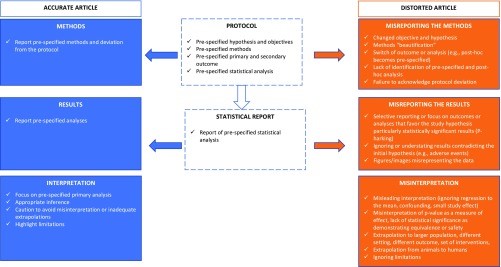
Figure 7: Le spin dans les articles scientifiques. Isabelle Boutron & Philippe Ravaud. PNAS. 2018; 115(11):2613-2619 (Copyright 2018 National Academy of Sciences)
Pour en savoir plus :
Boutron I, Ravaud P. Misrepresentation and distortion of research in biomedical literature. PNAS. 2018. 115(11):2613-2619 https://www.ncbi.nlm.nih.gov/pubmed/29531025
Yavchitz A, Ravaud P, Altman DG, Moher D, Hrobjartsson A, Lasserson T, Boutron I. A new classification of spin in systematic reviews and meta-analyses was developed and ranked according to the severity. Journal of Clinical Epidemiology. 2016. 75:56-65 https://www.ncbi.nlm.nih.gov/pubmed/26845744
Haneef R, Lazarus C, Ravaud P, Yavchitz A, Boutron I. Interpretation of Results of Studies Evaluating an Intervention Highlighted in Google Health News: A Cross-Sectional Study of News. PLoS ONE. 2015. 10(10):e0140889 https://www.ncbi.nlm.nih.gov/pubmed/26473725
Yavchitz A, Boutron I, Bafeta A, Marroun I, Charles P, Mantz J, Ravaud P. Misrepresentation of randomized controlled trials in press releases and news coverage: a cohort study. PLoS Medicine. 2012;9(9):e1001308 https://www.ncbi.nlm.nih.gov/pubmed/22984354
Boutron I, Dutton S, Ravaud P, Altman DG, Reporting and interpretation of randomized controlled trials with statistically nonsignificant results for primary outcomes, JAMA. 2010. 303(20):2058-64 https://www.ncbi.nlm.nih.gov/pubmed/20501928
Amélioration de la recherche primaire
L’étude des essais inclus dans des revues systématiques permet d’évaluer le gaspillage de recherche lié à l’emploi de méthodes inadéquates dans les études primaires. Notre équipe cherche à savoir dans quelle mesure ce gaspillage pourrait être évité, et comment. A ce jour, nos travaux ont montré qu’une large partie du gaspillage de recherche est évitable.
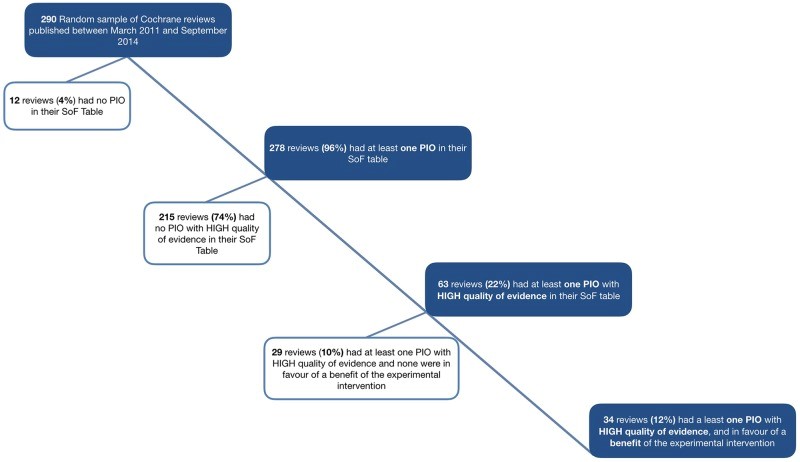
Figure 8: La prise en compte de résultats jugés importants par les patients dans un échantillon aléatoire de revues Cochrane. Youri Yordanov et al. PLoS ONE. 2018; 13(4):e0195460
Pour en savoir plus :
Yordanov Y, Dechartres A, Ignacio A, Viet-Thi T, Boutron I, Crequit P, Ravaud P. Avoidable waste of research related to outcome planning and reporting in clinical trials. BMC Medicine. 2018. 16:87 https://www.ncbi.nlm.nih.gov/pubmed/29886846
Yordanov Y, Dechartres A, Ravaud P. Patient-important outcomes in systematic reviews: Poor quality of evidence. PLoS ONE. 2018. 13(4):e0195460 https://www.ncbi.nlm.nih.gov/pubmed/29621329
Yordanov Y, Dechartres A, Porcher R, Boutron I, Altman DG, Ravaud P. Avoidable waste of research related to inadequate methods in clinical trials. BMJ. 2015. 350:h809 https://www.ncbi.nlm.nih.gov/pubmed/25804210
